PERSPECTIVA: La decisión de Biogen pone de manifiesto la necesidad de colaboración clínica y jurídica
En Biogen International GmbH contra Banner Life Sciences LLC, un tribunal del Tribunal de Apelación de los Estados Unidos para el Circuito Federal (CAFC) dictaminó que el alcance de la restauración del plazo de una patente en virtud del artículo 35 U.S.C. §156 solo incluye el principio activo de un producto aprobado (en este caso, el dimetilfumarato o DMF, el principio activo del Tecfidera® de Biogen) o un éster o sal de dicho principio activo.
Al confirmar la sentencia del tribunal de distrito, el CAFC coincidió en que el compuesto utilizado en el producto acusado de Banner (fumarato de metilo e hidrógeno, también conocido como fumarato de monometilo o MMF) no es ni el ingrediente activo ni un éster o sal de dicho ingrediente activo.
Por lo tanto, el CAFC no encontró ninguna infracción por parte de Banner de la parte del plazo de la patente en litigio, que se amplió debido a «retrasos» relacionados con el proceso de obtención de la autorización reglamentaria para comercializar Tecfidera® de Biogen.
Nos gustaría ejercer nuestra licencia literaria y retroceder en el tiempo, para revisar la historia y ofrecer un escenario hipotético «inverso» en el que Biogen, o cualquier innovador farmacéutico en una situación similar, toma una decisión diferente en las primeras fases de su programa de desarrollo de fármacos, lo que altera el resultado en este caso y supone una victoria para Biogen.
Al describir el escenario hipotético inverso, esperamos llamar la atención, aunque sea en retrospectiva, sobre las ventajas de una estrecha colaboración entre los asesores clínicos y jurídicos de un innovador a la hora de decidir, entre dos o más opciones, qué compuesto designar como el principal candidato a fármaco de la empresa.
La reivindicación 1, única reivindicación independiente de la patente objeto de litigio, US 7.619.001 B2, se reproduce a continuación:
- Método para tratar la esclerosis múltiple que comprende administrar a un paciente que necesita tratamiento para la esclerosis múltiple una cantidad de un preparado farmacéutico eficaz para tratar la esclerosis múltiple, el preparado farmacéutico comprende al menos un excipiente o al menos un vehículo o al menos una combinación de los mismos; y dimetilfumarato (DMF), metilhidrogenfumarato (MMF) o una combinación de los mismos. (abreviaturas añadidas)
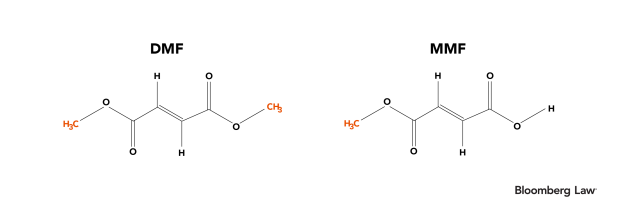
Además, a continuación se muestran las estructuras químicas del DMF y el MMF:

A riesgo de desvelar el final de este artículo, señalamos que incluso un examen superficial de sus estructuras químicas revela que el DMF es un éster metílico del MMF.
La patente en litigio tenía previsto expirar originalmente el 1 de abril de 2018. Su vigencia se prorrogó en virtud de lo dispuesto en el artículo 156 por 811 días, y la parte prorrogada de la vigencia expirará el 20 de junio. En referencia al artículo 156, el CAFC escribió:
- El inciso (b) limita el alcance de la extensión de la patente a «cualquier uso aprobado para el producto» y, además, en el caso de las patentes de métodos de tratamiento, a los usos también «reivindicados por la patente». § 156(b)(2). A efectos de la presente apelación, es fundamental señalar que el apartado (f) define «producto» como «el principio activo de [...] un nuevo medicamento [...] incluyendo cualquier sal o éster del principio activo». § 156(f)(2)(A).
Además, el CAFC añadió que:
- «Ingrediente activo» es un término técnico, definido por la FDA como «cualquier componente destinado a proporcionar actividad farmacológica u otro efecto directo», 21 C.F.R. §210.3(b)(7), y «debe estar presente en el medicamento cuando se administra» (cita omitida).
El DMF había estado en fase de desarrollo investigativo (IND 73061) en los Estados Unidos para el tratamiento de la esclerosis múltiple desde 2006. Cuando Biogen presentó su solicitud de nuevo fármaco (NDA) a la FDA en febrero de 2012, que fue aprobada por la FDA en marzo de 2013, la patente en litigio y el objeto de sus reivindicaciones ya habían sido concedidos mucho antes (noviembre de 2009).
Como se ha mencionado anteriormente, las solicitudes abarcaban el DMF, el MMF o una combinación de ambos. Solo podemos especular sobre los motivos (por ejemplo, mejor perfil de seguridad, mejor disponibilidad oral, estabilidad, facilidad de fabricación) por los que Biogen decidió seguir adelante con el proceso de aprobación a favor del DMF (en lugar del MMF, el único metabolito activo del DMF).
Sin embargo, es evidente que el MMF también estaba disponible, ya que estaba presente en una combinación de ésteres de fumarato que se encuentra en Fumaderm®, un medicamento aprobado en Alemania en 1994 para el tratamiento de la psoriasis. Suponemos, a efectos de este escenario hipotético inverso, que el MMF tampoco había sido aprobado previamente para su comercialización por la FDA y que habría sido clasificado como una nueva entidad química (NCE). Si nuestra suposición es correcta, y si todas las demás condiciones se mantienen iguales, Biogen podría haber optado por seguir adelante con el MMF como su candidato principal.
Si Biogen hubiera elegido el MMF como su candidato principal y finalmente hubiera obtenido la aprobación de la FDA para comercializarlo, Biogen aún podría haber seleccionado la patente en litigio para la restauración del plazo de la patente en virtud del artículo 156, ya que la patente en litigio cubre el uso aprobado del DMF, el MMF o una combinación de ambos.
Si Biogen hubiera elegido el MMF como ingrediente activo de Tecfidera®, habría disfrutado de la prórroga del plazo de la patente en litigio sin competencia de genéricos, ya que la prórroga habría cubierto el uso del MMF como ingrediente activo, «incluida cualquier sal o éster del ingrediente activo» según el artículo 156(f)(2)(A). Pfizer Inc. contra Dr. Reddy’s Labs. Ltd., 359 F.3d 1361 (Fed. Cir. 2004).
Por consiguiente, en el escenario hipotético inverso, si Banner hubiera presentado el DMF como ingrediente activo del producto acusado, Biogen habría prevalecido porque el DMF es un éster del ingrediente activo, el MMF. De hecho, Banner podría haber elegido cualquier éster del MMF y Biogen habría ganado igualmente.
Si Biogen hubiera elegido MMF como su candidato principal, el caso Biogen contra Banner nunca habría llegado a producirse.

