Personalized Medicine: 2021 FDA Guideposts for Progress – Focus on Therapeutics
The Personalized Medicine Coalition (PMC) released PERSONALIZED MEDICINE AT FDA: The Scope & Significance of Progress in 2021 (2021 Report), its recent survey of U.S. Food and Drug Administration (FDA)-approved personalized therapies and diagnostic tests that enable those therapies. The 2021 Report highlights that personalized medicines accounted for over a third of new drug approvals in 2021 and 25% or more of all FDA approvals for each of the last seven years.1
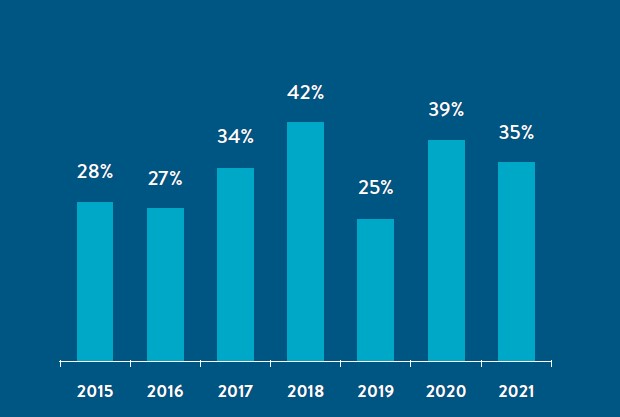
2021 FDA Therapeutic Approvals
Seventeen new molecular entities (NMEs)2 and new two cell-based therapies approved by FDA in 2021 were personalized therapies.3
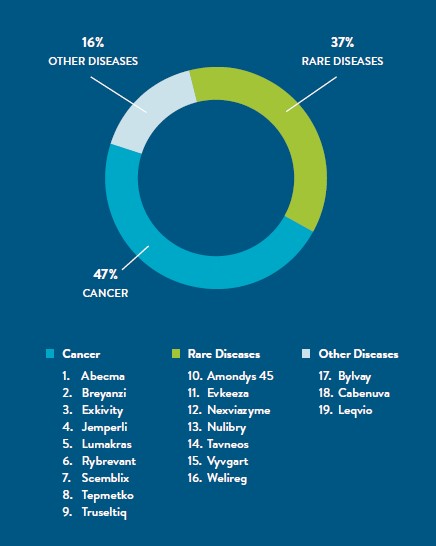
The approved NMEs treat:4 1. HIV (Cabenuva); 2. metastatic non-small cell lung cancer (Tepmetko); 3. familial hypercholesterolemia (Evkeeza); 4. Duchenne muscular dystrophy (Amondys); 5. molybdenum cofactor deficiency (Nulibry); 6. recurrent or advanced endometrial cancer (Jemperli); 7. locally advanced or metastatic non-small cell lung cancer (Rybrevant); 8. locally advanced or metastatic non-small cell lung cancer (Lumakras); 9. locally advanced or metastatic cholangiocarcinoma (Rybrevant); 10. prutitis in patients with progressive familial intrahepatic cholestasis (Bylvay); 11. Pompe disease (Nexviazyme); 12. von Hippel-Lindau disease (Welireg); 13. locally advanced or metastatic non-small cell lung cancer (Exkivity); 14. active severe vasculitis in combination with standard therapies such as glucocorticoids (Tavneos); 15. chronic myeloid leukemia in chronic phase (Scemblix); 16. generalized myasthenia gravis (Vyvgart); and 17. heterozygous familial hypercholesterolemia (Leqvio).
Two T cell-based CAR (chimeric antigen receptor) immune therapies were also approved. Breyanzi is an autologous CD-19 CAR T-cell therapy for the treatment of relapsed or refractory large B-cell lymphoma after two or more lines of systemic therapy. Abecma is an autologous modified BCMA (B-cell maturation antigen) targeted CAR T-cell therapy that treats relapsed or refractory multiple myeloma.
In addition to these therapies, many new personalized medicine indications were approved for existing drugs and drug combinations.5 Significant among the new approvals are: 1. Tecartus, the first approved CAR T-cell therapy for adult suffering from refractory B-cell precursor acute lymphoblastic leukemia (ALL); and 2. Leqvio, the 4th approved siRNA molecular therapy that targets and silences a portion of RNA involved in causing disease.
Continued Influence on America’s Health Care
The evolution and adoption of personalized or precision medicine can be measured by the growing number of FDA-approved therapies and the expansion to new indications of previously approved therapies. The 2021 Report highlights the growing importance and acceptance of precision medicine through the years. While the 2021 Report acknowledges that challenges remain in the areas of discovery, regulatory policy, coverage, reimbursement, and clinical adoption, personalized medicine is expected to “improve outcomes for patients and have a tremendous impact on the efficacy and efficiency of health care.”6
1 PMC categorizes personalized medicines as those therapeutic products for which the label includes reference to specific biological markers that are often identified by diagnostic tools, that guide decisions and/or procedures for their use in individual patients.
2 The FDA categorizes a new molecular entity as a product that contains active moieties that FDA had not previously approved, either as a single ingredient drug or as part of a combination product. Some drugs are characterized as NMEs for administrative purposes, but nonetheless contain active moieties that are closely related to active moieties in products that FDA has previously approved. FDA’s classification of a drug as an “NME” for review purposes is distinct from FDA’s determination of whether a drug product is a “new chemical entity” or “NCE” within the meaning of the Federal Food, Drug, and Cosmetic Act.
sup>3 2021 Report, page 12.
4 2021 Report, pages 7-8.
5 2021 Report, page 9 for a list of the new indications for approved therapies, including for example Keytruda and Rituxan.
6 2021 Report, page 17.




