
本記事は当初、 AIPLA化学実務クロニクルズ2025年秋号 ニュースレターに掲載されたもので、許可を得て再掲載されています。
I. 背景
第II相および第III相臨床試験プロトコルに基づく治療方法特許は、特許の独占期間を延長し、医薬品資産の特許ポートフォリオを戦略的に構築するために日常的に取得される。 これらの「後期世代」治療方法特許のクレームは、患者集団、投与量、投与スケジュール、有効性評価指標など、第II相または第III相臨床試験プロトコルの顕著な特徴を記載する。これは正当な理由に基づくもので、研究プロトコルの顕著な特徴はしばしば薬剤ラベルに記載され、時には明示的な有効な手順の一部として記載されるためである。
新規化学物質(NCE)において、次世代治療法特許は追加の特許期間を提供する。これは、物質の組成および/または広範な治療法の独占権を付与する基盤特許(先代特許)の特許期間を、時に数年超える場合がある。
適応外使用薬や新規投与プロトコルについては、第II相または第III相臨床試験プロトコルに基づく治療方法特許が 唯一の 有意義な特許独占権の源泉となり得る。例えば、当該化合物が既知であり、物質特許が既に失効しているか、あるいは間もなく失効する場合などが該当する。
従来の見解では、第II相または第III相臨床試験プロトコルに基づく特許出願を行うことが定められている 特に米国以外では、治療方法クレームの特許性を阻害し得る先行技術の作成を回避するため、 に、研究の公開開示を行う前に特許出願を行うことが推奨されている。これは、特に米国外において、治療方法クレームの特許性を妨げる可能性のある先行技術の創出を回避するためである。[1] 次世代治療方法特許の戦略的重要性を考慮すると、臨床試験に関連するあらゆる公開情報のタイミングを理解し、それに応じて特許出願の計画を立てるよう注意を払うべきである。
臨床試験に関連する公的開示の一例として、開発元による臨床試験プロトコルのClinicalTrials.gov(「CTG」)への「研究記録」としての掲載が挙げられる。[2] 研究記録の掲載は、米国が善意をもって推進する取り組みの一環であり、 とりわけ臨床研究に対する公衆の信頼を構築し、患者が参加資格のある試験を見つけられるよう支援することを目的としています。創薬企業は、最初の患者が試験に登録されてから21日以内に臨床試験プロトコルをFDAに提出する必要があります[3]。研究記録は提出後30日以内に公開される[4][5]。これらの期限を考慮すると、CTG上で研究記録が公開される正確な日を予測することは通常不可能です。このような「公開時期を確定できない」期限は、学術論文の確実な発表日や公開シンポジウムの日程とは異なり、おそらく当然のことながら、対応する治療方法の特許出願が提出される前に研究記録がCTGに掲載されるという事実パターンを引き起こしています。
II. 第102条(b)(1)(A)項の例外規定の適用
臨床試験自体は、35 U.S.C. § 102(a)(1)に基づく先行公衆利用とはみなされない。[6] ただし、CTG研究記録その他の臨床試験関連開示は、特許出願の有効出願日より前に公表された場合、§§ 102(a)(1) に基づく印刷物による公表および/または「その他の方法で公衆に利用可能」とみなされる。 したがって、こうした臨床試験関連の開示は、35 U.S.C. § 102(a)(1)に基づく予見性および/または35 U.S.C. § 103に基づく自明性に基づき、後に出願された特許出願の治療方法クレームを拒絶するために使用できる。
CTG研究記録または関連開示が、対応する米国治療方法特許出願の提出前に公に利用可能となった場合、§102(b)(1)(A)に基づく猶予期間の例外を援用し、§102(a)(1)に基づく開示の失格を主張することが可能である。 ただし、当該開示が当該出願の実効出願日より1年以内に行われた場合に限る。手続き上、審査官がCTG試験記録または関連開示に基づき35 U.S.C. §102(a)(1)および/または§103に基づく拒絶を行う場合、 出願人は、37 CFR § 1.130(「規則130」)に基づく宣誓書を提出することで猶予期間を主張できる。この宣誓書では、当該開示が発明者または共同発明者によって行われたことを立証し、先行技術としてのCTG試験記録または関連開示の除外を請求するものとする。
規則130の宣誓供述書の提出は一見単純に見えるが、最近のPTAB事例である Murray & Poole Enterprises Ltd. 対 Institut de Cardiologie de Montreal[7] は潜在的な落とし穴を示している。モントリオール心臓研究所(ICM)は、§102(b)(1)(A)に基づく猶予期間の例外を主張し、「Bouabdallaoui」を先行技術から除外しようとした。Bouabdallaouiは1年間の猶予期間内に公開され、「COLCOT」CTG研究記録の結果を拡張したものである。 Bouabdallaouiには7名の著者が記載されており、その2番目の著者であるタルディフ博士はICM特許の単独発明者であった。審判部は、猶予期間の主張が成立するかどうかは、タルディフ博士の宣誓供述書がBouabdallaouiが「他者による」ものではないと結論付けるのに十分な情報を提供しているかどうかにかかっていると明言した。[8] タルディフ博士の宣誓供述書は、 1名の (ブアブダラウイ)との業務関係についてのみ説明しており、 とりわけ、臨床試験実施におけるブーアブダラウイの支援への謝意および筆頭著者としての論文掲載の機会提供を挙げた。タルディフ博士の陳述書はまた、COLCOT多施設共同臨床試験の範囲と、ICMがスポンサーとしての地位にあることを、一部の施設とスポンサー間の契約書によって裏付けながら説明した。 委員会は、提供された施設-スポンサー契約は一部に過ぎず、提供された契約書の中でタルディフ博士を主任研究者として記載したものは一つもなかったと指摘した。[9] 最終的に、審議会は審理開始決定において、タルディフ博士の声明はブアブダラウィを先行技術として排除するには不十分であると判断した。[10]
As マレーが が示すように、臨床試験関連の開示の著者と特許出願の発明者との間のすべての相違点は、徹底的に説明されるべきである。先行技術拒絶の根拠とされた主題事項への貢献を否認する、いかなる余剰な著者(すなわち非発明者)による宣言も、臨床試験関連の開示が「他者による」ものではないことを立証するのに役立つ可能性がある。 CTG研究記録は、一般的な出版物とは異なり、臨床試験のスポンサーのみを記載し、研究設計を担当した特定の個人は記載しない。しかしながら、発明者(複数可)は、宣誓供述書においてCTG研究記録を自身の作業として証明することができる。発明者(複数可)を主任研究者(複数可)として明記するなど、発明者(複数可)とCTG研究記録を明確に結びつける裏付け書類も提供可能である。
III. 国際的な猶予期間の規定と出願戦略
米国に加え、いくつかの外国管轄区域でも猶予期間が設けられています。網羅的ではありませんが、表1には主要な外国管轄区域における猶予期間の適用可否、出願時期、および猶予期間を活用するための事前措置の必要性がまとめられています。実務家は、各国の細かな要件やタイミングを理解し、適切な猶予期間を活用するために、現地の法律顧問と緊密に連携すべきです。
表1
国 | 猶予期間あり | 出願時期(開示から) | 最初に提出すべき申請の種類 | 最初の出願は優先権書類として機能し得るか…† | 注記 |
|---|---|---|---|---|---|
AU | はい | 12か月 | AU標準出願またはPCT | はい(PCT用) | 積極的な措置は不要です。 |
BR | はい | 12か月 | 米国仮出願、BR、またはPCT | はい | 積極的な措置は不要です。 |
CA | はい | 12か月 | CAまたはPCT | いいえ | 積極的な措置は不要です。 |
CN | いいえ | — | — |
| CTG開示は猶予期間の対象とはなりません。 |
EP | いいえ | — | — |
| CTG開示は猶予期間の対象とはなりません。 |
JP | はい | 12か月 | JPまたはPCT | いいえ | 日本国出願または日本国内段階移行の提出から30日以内に、公衆開示のいくつかの特徴を記載した証明書を提出しなければならない。 |
KR | はい | 12か月 | 韓国またはPCT | はい、ただし優先権出願が(a)韓国のみを指定するPCT出願、または(b)直接の韓国出願である場合に限ります。 | 申請者/発明者の開示を証明する証拠書類を提出しなければならず、(i)開示の日付及び種類、(ii)開示者、並びに(iii)開示の内容を示すものとする。 |
MX | はい | 12か月 | 米国仮出願、MX、またはPCT | はい | PCTのMX国内出願またはMX国内段階移行を提出する際、公開日付けを所定の様式に記載しなければならない。 |
PH | はい | 12か月 | 米国仮出願、フィリピン、またはPCT | はい | 積極的な措置は不要です。 |
SG | はい | 12か月 | PCT | いいえ | 積極的な措置は不要です。 |
TW | はい | 12か月 | TW | いいえ | 積極的な措置は不要です。 |
米国 | はい | 12か月 | 米国仮特許またはPCT | はい | 積極的な措置は不要です。 |
†猶予期間の恩恵を受ける猶予期間経過後に出願されたPCT出願その他の出願について?
米国と同様に、オーストラリア、ブラジル、カナダ、日本、メキシコ、フィリピン、韓国、シンガポール、台湾はいずれも、最初の特許出願の提出日から12か月以内に提出されたCTG研究記録および関連開示に対して猶予期間を設けている。 ただし、最初の特許出願が後に出願される出願(例:PCT出願)の優先権書類として機能できるか否かについては差異がある。この場合、PCT出願の国内段階出願は 同様に この猶予期間の恩恵を受ける資格を有する。中国や欧州など特定の管轄区域では、CTG研究記録や関連開示に適用される猶予期間が実質的に存在しない。
これらの相違点を踏まえると、国際出願の優先順位に応じて複雑な潜在的な出願戦略が想定される。
シナリオ1は「典型的な」出願戦略であり、米国仮出願がファミリー内で最初に提出された出願となる。この出願戦略は、CTG研究記録または関連開示から12ヶ月以内に提出された米国仮出願が優先書類として機能する国々において、特許保護を追求するために採用できる。 を優先権書類として利用できる国において特許保護を求めるために採用できます。 として機能し、かつPCT出願の国内段階出願が米国仮出願の出願日に基づく猶予期間の恩恵を受ける資格がある国において、特許保護を追求するために採用できます。この出願戦略が利用可能な代表的な国には、米国、ブラジル、メキシコ、フィリピンが含まれます。
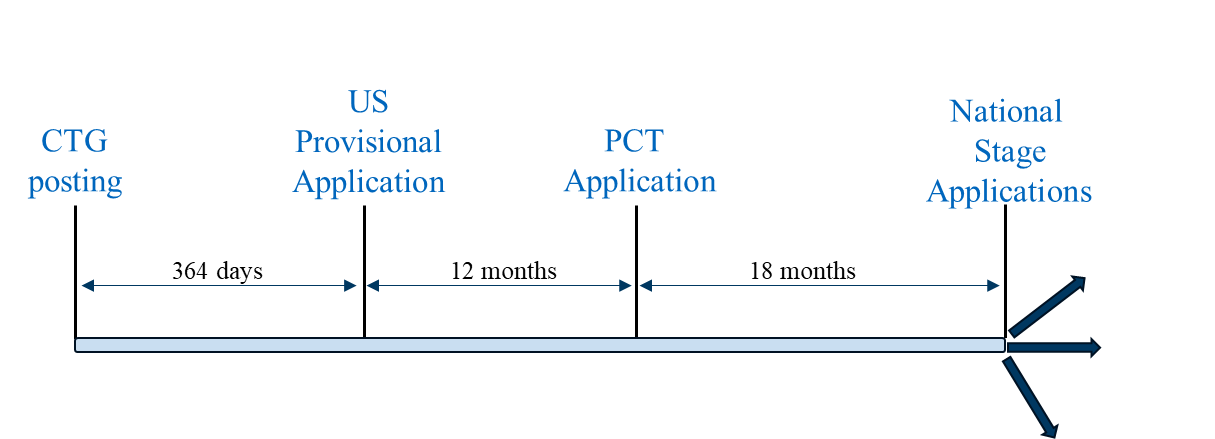
提出シナリオ1
シナリオ1は、実際にまたは実質的に猶予期間が存在しない国(例:中国および欧州)でも適用可能である。中国における絶対的新規性要件を克服するため、臨床試験関連の開示に含まれない計画中の商業的方法の可能な側面を、米国仮出願および/またはPCT出願に含めることができる。 欧州では、CTG研究記録や進行中の試験に関する発表は、新規性を損なうものと見なされないが、進歩性の判断には使用可能である。[11] 欧州における先行技術としての臨床試験の影響に関するガイダンスについては、2024年春号のAIPLA化学実務委員会による本テーマに関する有益な記事を参照されたい。[12]
シナリオ2は、国内出願が公開後1年以内にPCT加盟国または非PCT加盟国へ出願されなければ、猶予期間の適用対象とならない国々で採用可能です。この戦略が利用可能な代表的な国には、オーストラリア、カナダ、日本、韓国、シンガポール、台湾が含まれます。
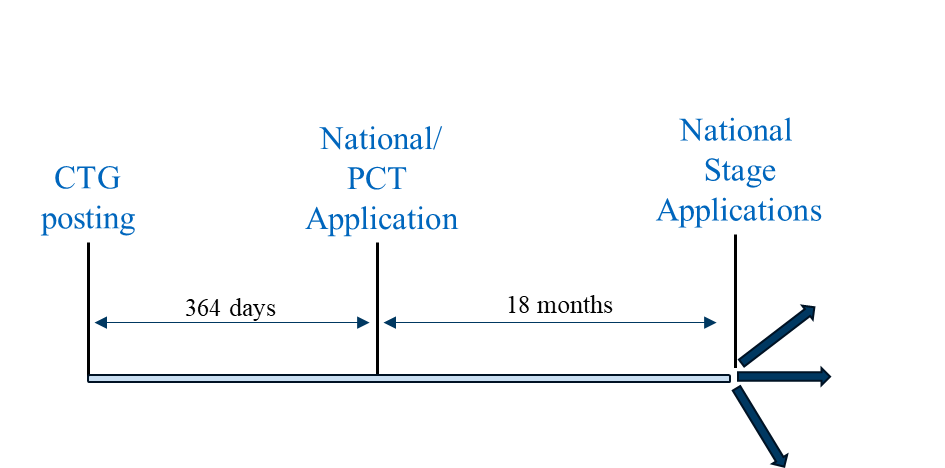
提出シナリオ2
シナリオ1は、以下の2点において潜在的な利点を提供する:(a) CTG研究記録の掲載前に米国仮出願を行うより保守的な出願戦略と比較して、(b) シナリオ2と比較して:(1) PCT出願に含めることが可能な臨床試験結果を生成するための最大時間、および(2) 最大特許期間の可能性。
シナリオ2では、CTG研究記録の登録から国内出願またはPCT出願までの期間が延長される利点がない。したがって、臨床試験の結果は、PCT出願または非PCT国の国内出願が提出される時点までに利用可能となる可能性が一般的に低い。ただし、上記の多くの国では、審査過程における出願後データの提出を認めており、その際に臨床試験結果を提示することが可能である。[13]
シナリオ3はシナリオ1とシナリオ2を統合した出願戦略である。まず、米国仮出願(シナリオ1に従う)、第1回PCT出願(PCT1)(シナリオ2に従う)、および非PCT加盟国における国内出願(シナリオ2に従う)を 。これらはCTG研究記録の掲載日から1年以内に、かつ同日に提出される。米国外での出願前には、外国出願許可の取得を検討し、必要に応じて取得すべきである。PCT1は、シナリオ2で説明したより厳格な優先権期間要件を有する管轄区域において国内出願化が可能である。
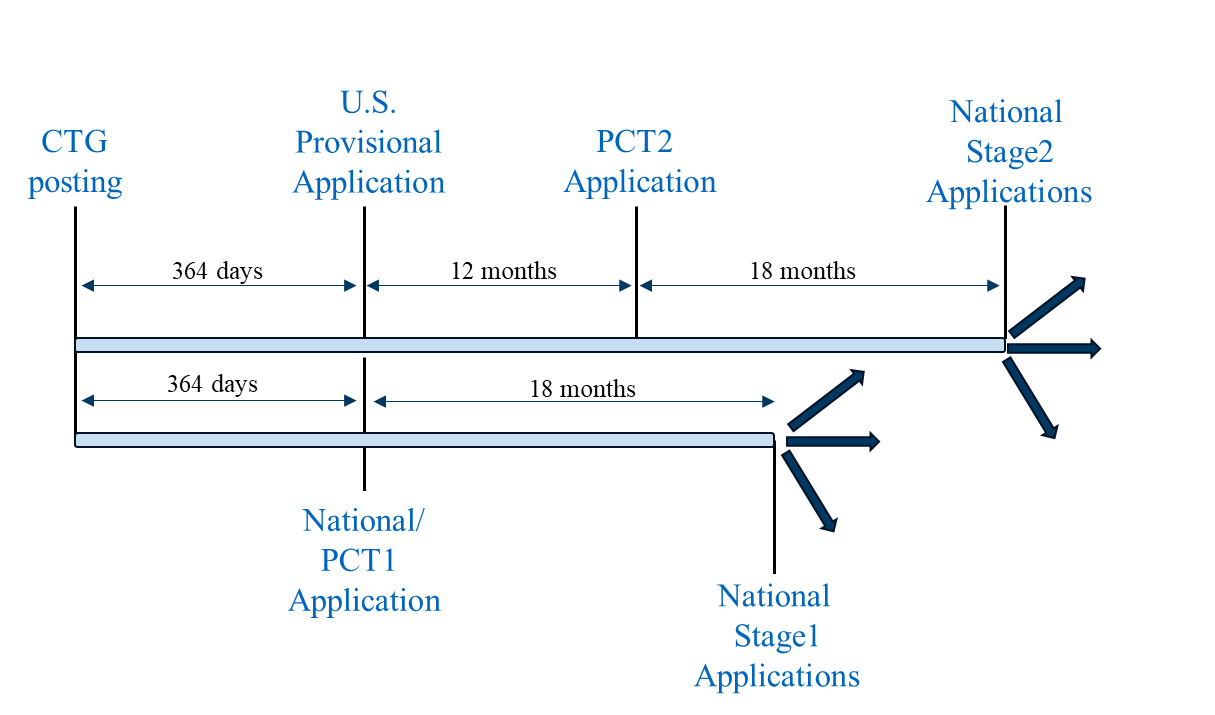
提出シナリオ3
米国仮出願の優先権を主張する第2のPCT出願(PCT2)は、臨床試験結果が利用可能な場合、当該米国仮出願の12か月条約期限日に出願できる。PCT2は、前述のシナリオ1と同様に、より緩和された猶予期間要件を有する管轄区域において国内出願化が可能である。
この特注アプローチは、利用可能な猶予期間の潜在的なメリットを最大限に活用すると同時に、臨床試験結果データの組み込み(PCT第2段階または国内段階出願審査中の追加データとして)を考慮します。その結果、治療方法の特許範囲の取得可能性が高まり、特許期間が延長されます。
IV. 結論
CTGによる第II相または第III相試験記録もしくは関連する公開情報の掲載は、臨床試験プロトコルに基づく後願特許出願における治療方法クレームの特許性を必然的に排除するものではない。驚くほど多くの法域では、CTG試験記録もしくは関連開示を先行技術として排除できる猶予期間を設けている 。ただし、1年以内に提出すべき特許出願の種類は管轄区域によって異なり、複雑な出願戦略を必要とする。ただし、1年以内に提出すべき特許出願の種類は管轄区域によって異なるため、複雑な出願戦略が必要となる。米国では、§102(b)(1)(A)の例外規定を用いてCTG試験記録を排除するには、実務家は規則130の宣誓供述書を慎重に起草し、特許出願の発明者と臨床試験のスポンサー及び主任研究者との関連性を明確に結びつけるべきである。 同様に、§102(b)(1)(A)の例外を用いて臨床試験関連の開示を除外するための規則130の宣誓書は、開示の著者と特許請求の範囲の対象の発明者との間のあらゆる相違点を明確に説明すべきである。
[1] 米国のほとんどの州では、「治療方法」に関する請求を そのものとしては、ただし、そのようなクレームは現地の慣行に従って再構成することが可能である。例えば、スイス型クレームや用途限定型クレームのための用途限定化合物として再構成できる。
[2] 42 U.S.C. § 282(j)(2)(A)
[3] 42 U.S.C. § 282(j)(2)(C)
[4] 42 U.S.C. § 282(j)(2)(D)
[5] 臨床試験の変更(プロトコルの変更を含む)も同様の仕組みでCTGに掲載されるため、特定の臨床試験については通常、CTG上に複数の研究記録が利用可能となる。
[6] 例えば、 サノフィ対グレンマーク・ファーマス社事件(米国), 204 F. Supp. 3d 665 (D. Del. 2016), aff’d sub nom., サノフィ対ワトソン・ラボラトリーズ社., 875 F.3d 636 (Fed. Cir. 2017) (ドネダロンを用いた患者治療方法に関する特許は、基準日前に特許取得の準備が整っておらず、したがって公的使用とはみなされない); In Re Omeprazole Patent Litigation, 536 F.3d 1361 (Fed. Cir. 2008)(第III相臨床試験は、発明が実施段階に至っておらず特許適格性を満たしていなかったため、公的使用とは認められない)。
[7] IPR2023-01064, 論文9(特許審判部、2024年1月16日)。
[8] 同上, 54ページ。
[9] 同上, 55ページ。
[10] 同上, 56ページ。
[11] T 158/96、T 715/03、T 1859/08 および T 2506/12
[12] ホルガー・トストマン博士、米国知的財産法協会(AIPLA)化学実務委員会ニュースレター、2024年春号、第12巻第1号、24ページ。
[13] カナダでは、実用性は実証または「合理的な予測」によって確立される 申請時における実証または「合理的な予測」によって確立される。




