
本文最初发表于 《AIPLA化学实务纪事》2025年秋季刊 通讯刊载,经授权转载于此。
一、背景
基于II期和III期临床试验方案的治疗方法专利通常被申请,以延长专利独占期并为药物资产战略性地构建专利组合。 此类"后期"治疗方法专利的权利要求书明确记载了II期或III期临床试验方案的核心特征,包括受试人群、剂量规格、给药方案及疗效评估指标。此举具有充分依据——研究方案的核心要素通常会出现在药品说明书中,有时甚至作为明确的操作步骤予以标注。
对于新化学实体(NCE),新一代治疗方法专利可提供额外专利期限,有时甚至比早期专利(即提供物质组成和/或广泛治疗方法独占权的基础专利)的专利期限长出数年。
对于转用药物或新型给药方案,基于II期或III期临床试验方案的治疗方法专利可能提供 唯一 有意义的专利排他性来源,例如当化合物已知且物质组成专利已过期或即将到期时。
传统智慧认为,应基于II期或III期临床试验方案提交专利申请 在 在研究公开披露之前提交专利申请,以避免形成可能排除治疗方法权利要求可专利性的现有技术,尤其在美国境外。[1] 鉴于后期治疗方法专利的战略重要性,需谨慎把握临床试验相关公开披露的时机,并据此规划专利申请提交策略。
此类临床试验相关公开披露之一,是将创新者的临床试验方案作为所谓的"研究记录"发布于ClinicalTrials.gov("CTG")网站。[2] 研究记录的公示是美国为确保人体临床试验透明化所作善意努力的一部分,旨在向 其中包括,旨在建立公众对临床研究的信任,并帮助患者找到可能符合参与条件的试验。创新者须在首位患者入组试验后21天内向FDA提交临床试验方案[3],研究记录须在提交后30日内完成公示[4][5]。鉴于这些时限要求,通常无法准确预测研究记录在CTG平台的具体公示日期。这种"无法预先登记"的截止期限——不同于期刊论文或公开研讨会的固定发布时间——导致出现这样一种事实模式:研究记录在对应治疗方法专利申请提交前便已发布至CTG平台,这种情况或许不足为奇。
二、第102(b)(1)(A)条例外条款的适用
根据《美国法典》第35编第102(a)(1)条,临床试验本身不被视为先前的公共使用。[6] 然而,若CTG研究记录及其他临床试验相关披露在专利申请的有效提交日期之前公布,则根据§§ 102(a)(1)被视为印刷出版物和/或"以其他方式向公众公开"。 因此,此类临床试验相关披露可依据《美国法典》第35编第102(a)(1)条作为现有技术驳回后续提交的专利申请中治疗方法的权利要求,并/或依据第103条作为显而易见性依据予以驳回。
若CTG研究报告或相关披露在提交对应美国治疗方法专利申请前已公开,可援引§102(b)(1)(A)规定的宽限期例外条款,依据§102(a)(1)排除该披露的效力—— 前提是该披露发生于申请有效提交日之前一年或更短时间内。程序上,若审查员依据CTG研究记录或相关披露依据《美国法典》第35编第102(a)(1)条和/或第103条作出驳回决定, 申请人可依据《联邦法规汇编》第37卷第1.130条("规则130")提交声明,证明该披露由发明人或共同发明人作出,并请求将CTG研究记录或相关披露排除于现有技术之外,从而援引宽限期。
尽管提交第130条声明看似简单明了,但近期专利审判与上诉委员会(PTAB)的一例案件—— Murray & Poole Enterprises Ltd. v. Institut de Cardiologie de Montreal[7] 揭示了潜在陷阱。蒙特利尔心脏病研究所(ICM)试图援引§102(b)(1)(A)的宽限期例外条款,将"Bouabdallaoui"排除在现有技术之外。该文献在一年宽限期内发表,并扩展了"COLCOT"CTG研究记录的成果。 Bouabdallaoui列出七位作者,其中第二位作者塔迪夫博士正是ICM专利的唯一发明人。专利审判与上诉委员会明确指出,是否援引宽限期取决于塔迪夫博士的声明是否提供了充分证据,足以证明Bouabdallaoui并非"他人所为"。[8] 塔迪夫博士的声明仅阐明了与 一位 位合著者(布阿卜达拉乌伊)的工作关系,其中 除其他事项外,承认Bouabdallaoui在临床试验中的协助作用,并为其提供第一作者发表机会。塔迪夫博士的声明还描述了COLCOT多中心临床试验的范围及ICM作为赞助方的地位,并援引了部分中心与赞助方之间的协议作为佐证。 委员会指出,仅提供了部分中心-赞助商协议,且在提供的协议中,均未将塔迪夫博士列为主要研究者。[9] 最终,委员会在启动程序决定中认定,塔迪夫博士的声明不足以否定布阿卜达拉维作为现有技术的资格。[10]
正如 默里 所示,临床试验相关披露的作者与专利申请发明人之间的所有差异均应详尽说明。任何非必要作者(即非发明人)就其对构成现有技术驳回依据的主题事项所作贡献的声明,有助于证明该临床试验相关披露并非"他人所为"。 与典型出版物不同,CTG研究记录仅列出临床试验的赞助方,未具体列明研究设计负责人。尽管如此,发明人仍可通过声明证明CTG研究记录属于其自身工作。同时可提交佐证文件明确关联发明人与CTG研究记录,例如将发明人列为主要研究者。
三、国际宽限期规定与申报策略
除美国外,多个外国司法管辖区也设有宽限期。表1虽非详尽无遗,但概括了常见外国申请地是否提供宽限期、申请提交时限以及是否需要主动采取措施利用宽限期等信息。实务工作者应与当地律师密切合作,深入理解各国细微的法律要求和时间节点,方能妥善运用各国家的可用宽限期。
表1
国家 | 宽限期可用 | 提交申请的时间(自披露之日起) | 首次申请应提交的类型 | 首次申请能否作为优先权文件……† | 注释 |
|---|---|---|---|---|---|
AU | 是的 | 12个月 | 澳大利亚标准申请或PCT | 是(针对PCT) | 无需采取主动措施。 |
BR | 是的 | 12个月 | 美国临时专利、BR或PCT | 是的 | 无需采取主动措施。 |
CA | 是的 | 12个月 | CA 或 PCT | 不 | 无需采取主动措施。 |
CN | 不 | — | — |
| CTG披露不符合宽限期要求。 |
EP | 不 | — | — |
| CTG披露不符合宽限期要求。 |
JP | 是的 | 12个月 | JP 或 PCT | 不 | 在提交日本专利国家申请或进入日本专利国家阶段后30天内,必须提交一份说明书,其中需描述公开披露的若干特征。 |
KR | 是的 | 12个月 | KR 或 PCT | 是的,但仅当优先权申请是(a)仅指定韩国的PCT申请,或(b)直接提交的韩国申请时。 | 必须提交证明申请人/发明人披露行为的证据文件,并显示:(一)披露的日期和类型;(二)披露方;(三)披露内容。 |
MX | 是的 | 12个月 | 美国临时专利、多国专利或PCT专利 | 是的 | 在提交PCT的MX国家申请或MX国家阶段进入申请时,必须在表格上注明公开披露日期。 |
PH | 是的 | 12个月 | 美国临时专利、菲律宾专利或PCT专利 | 是的 | 无需采取主动措施。 |
SG | 是的 | 12个月 | PCT | 不 | 无需采取主动措施。 |
TW | 是的 | 12个月 | TW | 不 | 无需采取主动措施。 |
美国 | 是的 | 12个月 | 美国临时专利或PCT | 是的 | 无需采取主动措施。 |
†对于在宽限期后提交的PCT申请或其他申请,能否享受宽限期的权益?
与美国、澳大利亚、巴西、加拿大、日本、墨西哥、菲律宾、韩国、新加坡及台湾地区相同,这些司法管辖区均对共同技术组(CTG)研究记录及相关披露提供宽限期,允许在首次专利申请提交日期后12个月内进行披露。 但各国存在差异:首次专利申请能否作为后续申请(如PCT申请)的优先权文件?若PCT申请进入国家阶段,该阶段申请将 同样 享有该宽限期权益。某些司法管辖区(如中国和欧洲)实际上不存在适用于CTG研究记录或相关披露的宽限期。
鉴于这些区别,人们可以设想出复杂的潜在申请策略,具体取决于国际申请的优先权安排。
方案1是"典型"的申请策略,即以美国临时申请作为该专利家族的首件申请。在以下国家申请专利保护时可采用此策略:若美国临时申请在CTG研究记录或相关披露后12个月内提交 可作为优先权文件 ,且PCT申请的国家阶段申请可基于美国临时申请的提交日期享受宽限期。可采用此申请策略的代表性国家包括美国、巴西、墨西哥和菲律宾。
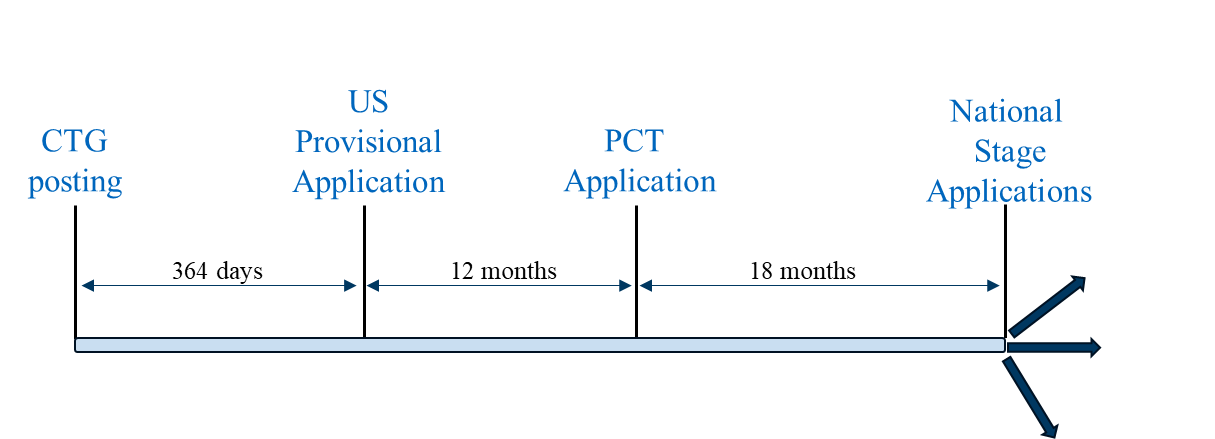
申报场景1
情景1也可适用于实际或实质上缺乏宽限期的国家(如中国和欧洲)。为突破中国专利法中绝对新颖性门槛,可将计划中的商业方法中未在临床试验相关披露中公开的潜在方面纳入美国临时申请和/或PCT申请。 在欧洲,临床试验组(CTG)研究记录或正在进行的试验公告虽可用于创造性分析,但不被视为破坏新颖性的依据。[11] 关于临床试验作为欧洲现有技术的指导意见,建议读者参阅2024年春季AIPLA化学实践委员会就此主题发表的专题文章。[12]
在某些国家,若要使国家申请有资格享受宽限期,必须在公开披露后一年内提交PCT或非PCT国家的国家申请。可采用此策略的代表性国家包括澳大利亚、加拿大、日本、韩国、新加坡和台湾地区。
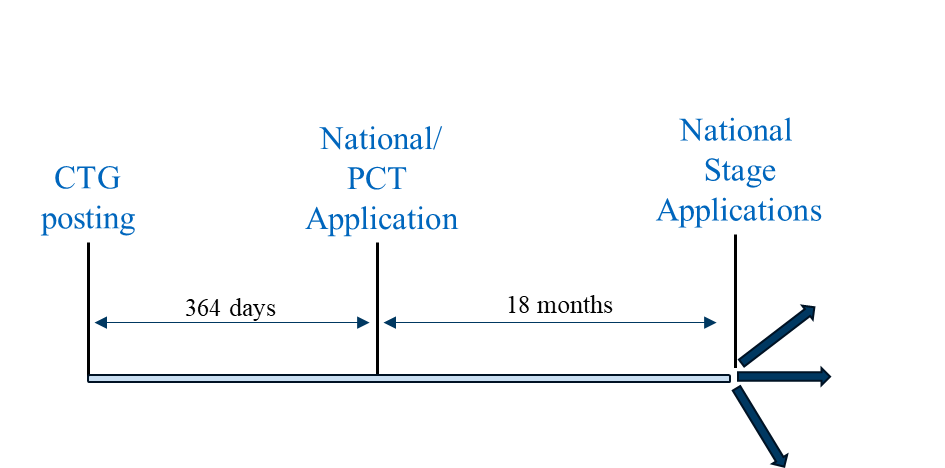
申报场景2
情景1相较于以下两种策略具有双重潜在优势:(a)更保守的申请策略——即在CTG研究记录发布前提交美国临时申请;(b)情景2:(1)为生成临床试验结果争取最大时间窗口,该结果若可用可纳入PCT申请;(2)实现专利期限最大化的可能性。
方案2无法提供临床试验研究记录提交与国家或PCT申请提交之间延长时限的优势。因此,在提交PCT申请或非PCT国家国内申请时,临床试验结果通常难以及时获取。不过,上述多数国家允许在审查过程中提交申请后数据,届时可提交临床试验结果。[13]
方案3将方案1与方案2整合为统一的申请策略。首先,在同一天且在CTG研究记录公布后一年内,依次提交美国临时申请(遵循方案1)、首份PCT申请(PCT1)(遵循方案2)以及非PCT国家/地区的国家申请(遵循方案2)。 。所有申请均需在CTG研究记录公布后一年内完成,且提交日期需集中在同一天。在提交任何美国境外申请前,应考虑并酌情获取境外申请许可。PCT1可在上述情景2所述严格宽限期要求的司法管辖区进行国家化。
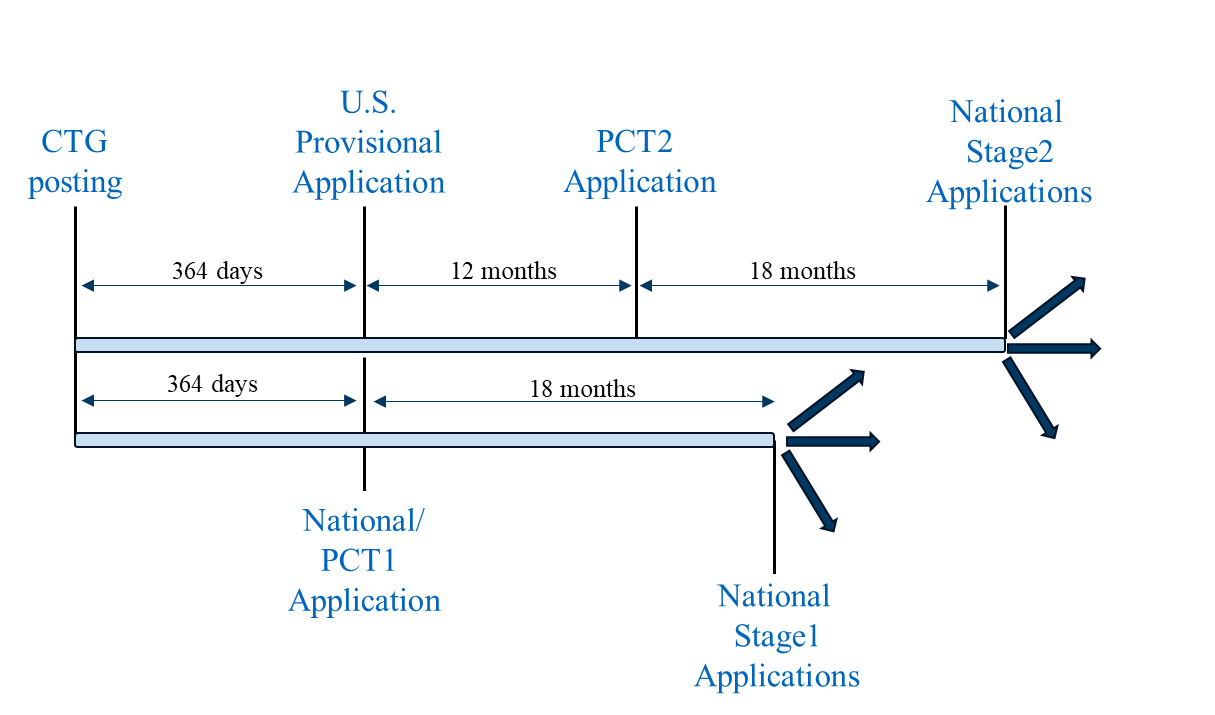
申报场景3
随后可在美国临时申请的12个月公约日期前提交第二份PCT申请(PCT2),该申请主张优先权并包含临床试验结果(如有)。PCT2可在上述情景1所述的宽限期要求更为宽松的司法管辖区进行国家化。
这种定制化策略在可行的情况下最大限度地发挥宽限期的潜在效益,同时确保纳入临床试验结果数据(无论是作为PCT第二阶段数据,还是在国家阶段申请审查过程中作为提交后的补充数据)。由此可提高获得治疗方法专利保护的几率,并延长专利保护期限。
四、结论
临床试验组(CTG)发布II期或III期研究记录或相关公开披露,并不必然排除基于该临床试验方案在后续专利申请中提出的治疗方法权利要求的可专利性。令人惊讶的是,许多司法管辖区都设有宽限期,在此期间CTG研究记录或相关披露可被排除作为现有技术。 若专利申请在披露后一年内提交。然而,必须在一年内提交的专利申请类型因司法管辖区而异,导致申请策略复杂化。在美国,若要依据§102(b)(1)(A)例外排除CTG研究记录,实务者应谨慎起草规则130声明,明确将专利申请的发明人与临床试验的赞助方及主要研究者建立关联。 同理,运用§102(b)(1)(A)例外排除临床试验相关公开的规则130声明,必须明确阐述公开内容的作者与所主张主题的发明人之间存在的所有差异。
[1] 大多数美国以外的司法管辖区均不允许就"治疗方法"本身提出诉讼 本身,但此类权利要求可根据当地惯例重新表述,例如改为瑞士式权利要求和/或用途型权利要求中的用途限定化合物。
[2] 《美国法典》第42编第282(j)(2)(A)条
[3] 《美国法典》第42编第282(j)(2)(C)条
[4] 《美国法典》第42编第282(j)(2)(D)条
[5] 临床试验的变更(包括方案变更)也通过相同机制发布至CTG平台,因此特定临床试验在CTG上通常会存在多个研究记录。
[6] 参见,例如: 赛诺菲诉格伦马克制药公司案,美国, 204 F. Supp. 3d 665 (D. Del. 2016),经上诉维持原判,案名为 赛诺菲诉沃森实验室公司案案,875 F.3d 636 (联邦巡回法院 2017) (一项关于使用多奈达隆治疗患者的方法专利在关键日期前尚未具备可专利性,因此不构成公开使用); 奥美拉唑专利诉讼案案,536 F.3d 1361(联邦巡回法院2008年)(因发明尚未付诸实践,故不符合专利申请条件,故第三阶段临床试验不构成公开使用)。
[7] IPR2023-01064,第9号文件(专利审判与上诉委员会,2024年1月16日)。
[8] 同上。,第54页。
[9] 同上。, 第55页。
[10] 同上。, 第56页。
[11] T 158/96、T 715/03、T 1859/08 及 T 2506/12
[12] 霍尔格·托斯特曼博士,《美国知识产权律师协会化学实践委员会通讯》,2024年春季刊,第12卷第1期,第24页。
[13] 在加拿大,实用性通过证明或“合理预测”来确立 。




