Rendre les aliments "sains" à nouveau : Résolution de la FDA pour une année 2025 plus saine

La Food and Drug Administration (FDA) américaine a commencé l'année 2025 avec la résolution de rendre les aliments à nouveau « sains » en annonçant trois nouvelles règles définitives et proposées visant à aider les consommateurs à identifier plus facilement les choix alimentaires sains. Ces règles, qui comprennent une nouvelle interdiction de l'utilisation du colorant rouge n° 3, une définition révisée des allégations « saines » pouvant être faites sur les aliments et de nouvelles exigences proposées pour l'étiquetage nutritionnel sur le devant des emballages alimentaires, ont des implications pour de nombreux acteurs de l'industrie alimentaire.
Bien que ces initiatives en faveur d'une alimentation saine aient été lancées sous l'administration Biden, elles s'inscrivent directement dans le programme de la nouvelle administration Trump pour le ministère américain de la Santé et des Services sociaux (HHS). Le secrétaire du HHS récemment confirmé sous la deuxième administration Trump, Robert F. Kennedy Jr., a fait campagne pour limiter l'utilisation des colorants alimentaires et s'attaquer aux « aliments malsains » hautement transformés qui contribuent à l'obésité. Nous pensons donc que ces nouvelles règles resteront en vigueur, malgré le gel récent des nouvelles règles proposées par la nouvelle administration et la recommandation de reporter les nouvelles règles définitives (qui font actuellement l'objet d'un examen judiciaire). Les parties prenantes concernées par la réglementation devraient prendre dès maintenant des mesures pour se mettre en conformité.
Révocation de l'utilisation du colorant rouge n° 3 dans les aliments et les médicaments ingérables
Le 16 janvier 2025, la FDA a annoncé qu'elle avait modifié sa réglementation sur les colorants alimentaires afin de révoquer l'autorisation d'utilisation du FD&C Red No. 3 (communément appelé « colorant rouge n° 3 ») comme colorant alimentaire dans les aliments et les médicaments (90 Fed. Reg. 4628 (16 janvier 2025)). Par conséquent, à compter du 15 janvier 2027, le colorant rouge n° 3 ne sera plus autorisé dans les produits alimentaires tels que les bonbons, les gâteaux, les cupcakes, les biscuits, les desserts glacés, les glaçages et les nappages, et tous les certificats d'utilisation du colorant rouge n° 3 dans ces produits cesseront d'être valables. Le colorant rouge n° 3 sera interdit d'utilisation comme additif colorant dans les médicaments ingérables à compter du 18 janvier 2027. Tout produit alimentaire et médicament ingérable (y compris les importations) contenant du colorant rouge n° 3 sans certification en vigueur sera considéré comme frelaté.
Il convient de noter que, bien que d'autres pays autorisent encore certaines utilisations du colorant rouge n° 3 (parfois appelé « érythrosine » à l'étranger), les produits alimentaires fabriqués à l'étranger et importés aux États-Unis devront également se conformer à cette nouvelle interdiction. Bien que la FDA n'ait pas encore indiqué si la mise en œuvre de cette nouvelle règle serait encore retardée, les acteurs de l'industrie alimentaire devraient prendre dès maintenant des mesures pour reformuler tout produit contenant du colorant rouge n° 3.
La décision de la FDA concernant le colorant rouge n° 3 n'est pas surprenante dans une certaine mesure, étant donné que l'agence a interdit l'utilisation de ce colorant dans les cosmétiques en 1990 et que son utilisation est déjà interdite dans les aliments dans d'autres pays. Reste à voir si la FDA poursuivra dans la voie réglementaire qu'elle a empruntée. Des pétitions ont été déposées auprès de l'agence afin d'interdire d'autres produits chimiques utilisés dans l'alimentation, tels que les PFAS, le BPA, le TCE et le dioxyde de titane, dont certaines sont en attente depuis des années. De plus, avant le changement d'administration, la FDA a annoncé qu'elle développait un « processus systémique » pour mener des évaluations post-commercialisation des produits chimiques dans les aliments, y compris les ingrédients GRAS, les additifs colorants, les substances en contact avec les aliments et les contaminants potentiels, et a créé un registre pour recueillir les commentaires du public. À la fin de la période de consultation, plus de 34 000 commentaires avaient été soumis à la FDA, ce qui témoigne d'un intérêt considérable pour cette question. Compte tenu des priorités énoncées par le nouveau secrétaire du HHS, nous ne serions pas surpris que la FDA poursuive ses efforts de réglementation dans ce domaine.
Exigences actualisées pour les allégations « santé »
Ces dernières années, la FDA a exprimé son inquiétude face à la prévalence croissante des maladies chroniques évitables et des problèmes de santé liés à des choix alimentaires malsains. Les recherches menées par la FDA démontrant que les consommateurs américains choisissent leurs aliments en fonction des informations facilement accessibles, la FDA s'est attachée à réviser ses réglementations en matière d'étiquetage alimentaire afin de fournir aux consommateurs des informations supplémentaires sur les bienfaits nutritionnels (ou l'absence de bienfaits) des aliments. Il en résulte la révision de la règle finale relative aux allégations « santé » et une proposition de règle imposant la mention des informations nutritionnelles sur le devant des emballages, comme indiqué ci-dessous.
Les préambules à ces efforts de réglementation démontrent que la réflexion de la FDA a été fortement influencée par les Recommandations alimentaires pour les Américains, 2020-2025 (les « recommandations alimentaires »). En vertu de la loi de 1990 sur la surveillance nutritionnelle nationale et la recherche connexe, le ministère américain de l'Agriculture (USDA) et le HHS doivent publier les recommandations alimentaires au moins une fois tous les cinq ans, sur la base des connaissances scientifiques et médicales actuelles. Les recommandations alimentaires actuelles minimisent l'importance des nutriments individuels ou des groupes d'aliments pris isolément au profit d'une approche plus holistique qui met l'accent sur les habitudes alimentaires à différentes étapes de la vie. Selon les recommandations alimentaires, une alimentation saine met l'accent sur les aliments riches en nutriments dans tous les groupes alimentaires, tout en respectant les limites caloriques et en limitant les sucres, les graisses saturées et le sodium.
Les réglementations de la FDA incluent des paramètres relatifs aux allégations « santé » depuis 1994, mais les exigences n'ont pas beaucoup changé depuis cette date, même si la science nutritionnelle a évolué. Les paramètres établis dans le cadre de la réglementation initiale étaient assez rigides et comprenaient des limites spécifiques pour les graisses totales, les graisses saturées, le cholestérol et le sodium, ainsi que des quantités minimales de nutriments dont la consommation était encouragée (par exemple, la vitamine A, le fer, les protéines). En vertu de la règle de 1994, un aliment devait respecter toutes les limites des nutriments « déconseillés » et contenir la quantité minimale d'au moins un des nutriments « encouragés » pour pouvoir porter la mention « sain ». Cela a eu pour effet d'exclure certains aliments « riches en nutriments » souvent considérés comme sains par les consommateurs, tels que le saumon (en raison de sa teneur en graisses).
La nouvelle règle définitive (89 Fed. Reg. 106,064 (27 décembre 2024)) propose une approche plus souple, conforme aux recommandations alimentaires révisées. Les connaissances scientifiques actuelles en matière de nutrition mettent l'accent sur les aliments riches en nutriments, tels que les fruits, les légumes et les céréales complètes, dans le cadre d'une alimentation saine. Les aliments et boissons riches en nutriments sont définis comme ceux qui fournissent des vitamines, des minéraux et d'autres nutriments bénéfiques pour la santé, mais qui contiennent peu ou pas de sucres ajoutés, de graisses saturées ou de sodium. Par conséquent, les aliments qui répondent aux critères de « santé » définis dans la nouvelle règle sont ceux qui, en raison de leur profil nutritionnel global, peuvent constituer la « base » ou les « éléments constitutifs » d'un régime alimentaire globalement sain recommandé par les recommandations alimentaires.
En vertu de cette règle, une allégation alimentaire « saine » « suggère qu'un aliment, en raison de sa teneur en nutriments, peut être utile pour maintenir des habitudes alimentaires saines, lorsqu'il existe également des informations implicites ou explicites sur la teneur nutritionnelle de l'aliment (par exemple, « sain »). » Voir 89 Fed. Reg. 106 064, 106 161. En général, pour répondre aux nouveaux critères applicables aux allégations « sain » sur les aliments, y compris les allégations selon lesquelles les aliments sont « bons pour la santé » ou « plus sains », les produits alimentaires (y compris les aliments individuels, les produits mélangés, les plats principaux et les repas) doivent (1) par exemple, contenir une certaine quantité d'aliments (appelée « équivalent groupe alimentaire ») provenant d'au moins un des groupes ou sous-groupes alimentaires recommandés par les Dietary Guidelines for Americans (par exemple, légumes, fruits, céréales complètes, produits laitiers sans matière grasse ou à faible teneur en matière grasse, viande maigre, fruits de mer, œufs, haricots, pois, lentilles, noix ou graines) et (2) respecter des limites spécifiques en matière de sucres ajoutés, de graisses saturées et de sodium (sur la base d'un pourcentage de la valeur quotidienne (DV) pour ces nutriments). Selon les nouveaux critères, certaines catégories d'aliments (légumes, fruits, fruits de mer, lentilles, noix et graines, entre autres) peuvent automatiquement bénéficier de l'allégation « sain » en raison de leur densité nutritionnelle, à condition qu'ils ne contiennent aucun ingrédient supplémentaire autre que de l'eau. Et certains aliments qui ne pouvaient pas bénéficier de l'allégation « sain » selon l'ancienne règle en raison de leur teneur en matières grasses peuvent désormais en bénéficier, notamment les avocats, le saumon et l'huile d'olive. À l'inverse, certains produits alimentaires qui étaient considérés comme « sains » selon l'ancienne règle ne le sont plus, notamment le pain blanc enrichi, les yaourts très sucrés et les céréales très sucrées.
La nouvelle règle contient également une exigence de justification. Les fabricants de denrées alimentaires pour lesquelles des allégations « santé » sont faites doivent établir et conserver des registres écrits justifiant ces allégations « santé » conformément aux nouvelles exigences, sauf lorsque l'étiquetage nutritionnel des aliments indique clairement que les exigences sont respectées.
L'industrie alimentaire peut commencer à se conformer volontairement à la nouvelle règle à compter du 25 février 2025 et doit s'y conformer avant le 25 février 2028. Par conséquent, l'industrie alimentaire devrait prendre dès maintenant des mesures pour examiner toutes les allégations « santé » faites pour ses produits, évaluer si ces allégations doivent être modifiées à la lumière de la nouvelle règle définitive et documenter les preuves à l'appui de ses allégations.
Nous ajoutons que les allégations santé figurant sur les étiquettes alimentaires font l'objet d'une surveillance étroite de la part des avocats spécialisés dans les recours collectifs en matière de fraude à la consommation (en particulier en Californie et à New York) et que le respect des exigences de la FDA en matière d'allégations « santé » ne permettra pas nécessairement d'éviter ces poursuites judiciaires si un tribunal estime que d'autres aspects de l'étiquette ou de l'emballage rendent l'allégation trompeuse dans son ensemble. Par conséquent, les fabricants de produits alimentaires devraient travailler en étroite collaboration avec des avocats expérimentés pour formuler des allégations « santé » et s'assurer que ces allégations sont correctement étayées.
Étiquetage nutritionnel
Le 16 janvier 2025, la FDA a publié une proposition de règlement (90 Fed. Reg. 5426 (16 janvier 2025)) (la « proposition de règlement ») qui, si elle est adoptée, imposerait l'apposition d'une étiquette nutritionnelle sur le devant de la plupart des emballages alimentaires, appelée « encadré d'informations nutritionnelles », afin d'aider les consommateurs à identifier plus facilement les aliments sains. Cette nouvelle étiquette obligerait les fabricants à indiquer les quantités relatives de graisses saturées, de sodium et de sucres ajoutés dans une portion du produit alimentaire, et à préciser si ces quantités sont faibles, moyennes ou élevées. Le format proposé par la FDA pour la nouvelle étiquette est présenté ci-dessous :
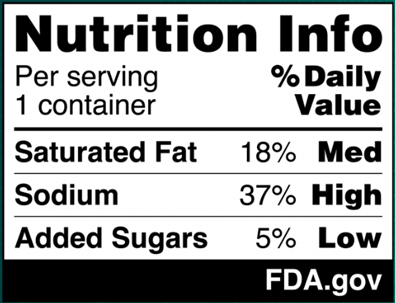
Les fourchettes proposées par la FDA pour chaque catégorie sont les suivantes :
- Faible : 5 % de la valeur quotidienne (VQ) ou moins
- Moyenne : 6 % à 19 % de la valeur quotidienne
- Élevé : 20 % DV ou plus
En proposant ces fourchettes de VQ, la FDA a pris en compte l'historique réglementaire du pourcentage de VQ, l'engagement de l'agence à aider les consommateurs à comprendre le concept de pourcentage de VQ dans le contexte de l'alimentation quotidienne d'une personne, ainsi que les définitions réglementaires existantes de l'agence pour les allégations relatives à la teneur en nutriments (y compris les définitions établies pour les allégations « faible » et « élevé »), entre autres facteurs. La FDA estime que les fourchettes qu'elle propose pour les descriptions interprétatives – et en particulier sa désignation de 5 % VQ ou moins comme « faible » et de 20 % VQ ou plus comme « élevé » – sont conformes à son approche réglementaire de longue date.[1] Toutefois, la FDA invite les parties intéressées à lui faire part de leurs commentaires sur ses conclusions et son analyse.
Informations nutritionnelles
Dans le préambule à la règle proposée, la FDA reconnaît que certains fabricants incluent déjà volontairement une mention des calories sur le devant des emballages alimentaires, conformément à la réglementation en vigueur. La FDA invite les acteurs du secteur à lui faire part de leurs commentaires sur l'inclusion d'une mention obligatoire ou volontaire des calories dans le tableau nutritionnel proposé, ainsi que de leurs suggestions sur la manière dont la FDA pourrait envisager d'inclure des informations quantitatives sur les calories (par exemple, « faible », « moyen », « élevé ») dans ce tableau (y compris toute nouvelle donnée ou autre information sur laquelle la FDA pourrait fonder cette interprétation).
Coûts prévus
Un aspect notable de la règle proposée est son coût prévu pour l'industrie, que la FDA a analysé dans le cadre de l'élaboration de la règle. La FDA a quantifié les coûts estimés du réétiquetage pour l'ensemble de l'industrie des aliments emballés entre 66 et 154 millions de dollars par an sur une période de dix ans. En outre, bien que la reformulation des produits ne soit pas une exigence ni un objectif déclaré de la règle proposée, la FDA reconnaît que celle-ci pourrait inciter certains producteurs alimentaires à entreprendre des efforts volontaires de reformulation. La FDA estime que les coûts annualisés de la reformulation se situeraient entre 125 et 377 millions de dollars sur une période de dix ans. La FDA reconnaît la possibilité que certains de ces coûts de réétiquetage/reformulation soient répercutés sur les consommateurs (au moins en partie).
Si cette proposition est adoptée, les entreprises dont le chiffre d'affaires annuel dans le secteur alimentaire est supérieur ou égal à 10 millions de dollars devront se conformer à ces exigences dans les trois ans suivant la date d'entrée en vigueur de la règle définitive. Les entreprises dont le chiffre d'affaires annuel dans le secteur alimentaire est inférieur à 10 millions de dollars devront se conformer à ces exigences dans les quatre ans suivant la date d'entrée en vigueur de la règle définitive. La FDA accepte les commentaires sur cette nouvelle proposition de règle jusqu'au 16 mai 2025. Les acteurs du secteur alimentaire devraient envisager de soumettre leurs commentaires sur cette proposition de règlement. Les membres de l'équipe Foley spécialisée dans l'industrie agroalimentaire ont une grande expérience dans l'aide aux acteurs réglementés pour la préparation de commentaires sur les réglementations de la FDA. Tous les auteurs se feront un plaisir de vous fournir des informations supplémentaires.
Gel réglementaire
Comme il est d'usage pour une nouvelle administration, l'un des premiers décrets présidentiels (« EO ») du président Trump gèle toutes les réglementations en suspens proposées dans les derniers jours de l'administration Biden. Le décret encourage un examen de 60 jours de toutes les règles ou directives proposées, avec une consultation supplémentaire du directeur du Bureau de la gestion et du budget (OMB) si nécessaire pour « les règles qui soulèvent des questions importantes en matière de faits, de droit ou de politique ».
Prochaines étapes
Bien qu'il existe une certaine incertitude quant au calendrier, dans l'ensemble, l'industrie devrait se préparer à la possibilité que ces règles et ordonnances entrent en vigueur. Par conséquent, les acteurs de l'industrie alimentaire devraient agir dès maintenant pour :
- Commencer à planifier la reformulation des produits contenant le colorant rouge n° 3 ;
- Examiner et évaluer les allégations « santé » faites à propos de leurs produits, et documenter leur justification conformément au nouveau cadre « santé » ; et
Envisagez de soumettre vos commentaires sur la nouvelle règle proposée exigeant l'apposition d'étiquettes nutritionnelles sur le devant des emballages.
[1] La FDA ne dispose d'aucune réglementation établissant une allégation nutritionnelle « moyenne » pour un nutriment quelconque. Dans le préambule à la règle proposée, la FDA adopte une approche pragmatique pour définir ce terme. Voir 90 Fed. Reg. 5426, 5445 (« L'adjectif « moyen » est défini, par exemple, comme « se situant entre une quantité, une taille, un degré ou une valeur supérieurs et inférieurs [...] et « intermédiaire en termes de quantité, de qualité, de position, de taille ou de degré [...] ». La signification courante de l'adjectif « moyen » correspond donc à la signification de l'interprétation [...] que nous proposons. »). Ce qui revient à dire que les objectifs « bas » et « élevés » sont vraiment ce qui importe aux fins des commentaires sur la règle proposée.







